Hipra nos acerca un completo informe para el productor porcino y médicos veterinarios sobre la enfermedad de Glässer y su control.
Desde su descubrimiento, los antibióticos han sido una herramienta esencial para luchar contra las enfermedades bacterianas, tanto en medicina humana como veterinaria. Sin embargo, esa misma eficacia ha tenido como consecuencia el relegar a un segundo plano el desarrollo y uso de vacunas frente a estas infecciones.
Ahora nos encontramos en una situación en que las resistencias a los antimicrobianos son uno de los mayores problemas sanitarios a nivel mundial y disponemos de pocas vacunas eficaces para combatir las enfermedades bacterianas, especialmente las de los animales. Estamos entrando en una época donde las exigencias de reducción en el uso de antimicrobianos están centrando muchas políticas sanitarias, tanto en medicina humana como en veterinaria.


Los peligros de la aparición de multiresistencias, frecuentes en algunos patógenos, son evidentes. Pero, ¿podemos controlar las enfermedades bacterianas en las granjas porcinas sin antibióticos? Es un gran reto, pero se está trabajando intensamente desde el mundo de la investigación y la industria para llegar a conseguirlo. Un paso en ese sentido nos lleva definitivamente a la priorización de nuevas estrategias, como la implementación de vacunas.
Enfermedad de Glässer
La enfermedad de Glässer está causada por Haemophilus parasuis, una bacteria que sólo infecta al cerdo. Esta enfermedad afecta principalmente a los lechones en la fase de transición y tiene un gran impacto económico en el sector porcino de todo el mundo. H. parasuis es una bacteria presente en básicamente todas las granjas, que coloniza los lechones a una edad muy temprana.
La aparición de la enfermedad de Glässer está normalmente relacionada con situaciones de estrés en los animales, como el destete temprano o el movimiento y la mezcla de animales. Además, la aparición de esta enfermedad también está favorecida por infecciones con otros patógenos.
Antibióticos perinatales
Como en el caso de otras enfermedades causadas por colonizadores tempranos, su control se ha realizado habitualmente mediante tratamientos metafilácticos perinatales. Un efecto ignorado de estos tratamientos es la alteración que producen en las comunidades bacterianas que componen la microbiota natural de los animales, y que puede tener un efecto perjudicial para la salud del lechón.
La microbiota tiene varias funciones, incluidas la maduración del sistema inmune y la exclusión de patógenos por competencia, por lo que su alteración, o disbiosis, puede suponer un incremento de la susceptibilidad de los animales frente a diversas infecciones.
Patogenia de la enfermedad de Glässer y diversidad de cepas de H. parasuis

Tras la colonización inicial del tracto respiratorio superior, las cepas virulentas pueden alcanzar el pulmón, donde sobreviven a la acción de los macrófagos alveolares. La multiplicación de las cepas virulentas de H. parasuis en el pulmón y la posterior invasión del torrente circulatorio causa una inflamación grave, que se refleja en las lesiones características de poliserositis.
Los factores de virulencia que se han identificado hasta el momento incluyen la cápsula, los autotransportadores triméricos asociados a virulencia (o VtaA del inglés “virulence-associated trimeric autotransporters”), el lipooligosacárido (LOS), o la toxina citoletal distendente (CDT). El papel específico de cada factor en la patogenia no se ha determinado en profundidad, pero hay indicaciones de que la cápsula y dos VtaA (VtaA8 y VtaA9) juegan un papel en la resistencia a la fagocitosis (Olvera et al., 2009; Costa-Hurtado et al., 2012).
Por otro lado, las cepas no virulentas se mantienen en el tracto respiratorio superior, ya que en el caso de que lleguen al pulmón, son destruidas por la acción fagocítica de los macrófagos alveolares.
Factores que afectan la aparición de la enfermedad
Mientras que H. parasuis está presente como colonizador en la práctica totalidad de granjas, la enfermedad de Glässer sólo se observa en un número menor de ellas. Los principales factores que afectan el desarrollo de la enfermedad de Glässer son la virulencia de las cepas de H. parasuis, la inmunidad de los lechones, la existencia de coinfecciones por otros patógenos y factores asociados al manejo, como la ventilación o la densidad de los animales.

La reducción de la diversidad bacteriana de la microbiota es también un efecto no deseado de los antibióticos, que aumentaría la predisposición de los lechones a sufrir enfermedades. La presencia de cepas virulentas en la granja constituye un factor de riesgo para el desarrollo de enfermedad por H. parasuis, mientras que la presencia de cepas no virulentas puede proporcionar protección frente a la exposición posterior a cepas virulentas (Brockmeier et al., 2013).
La realidad en una granja suele ser compleja, ya que es habitual encontrar una alta variedad de cepas distintas, que pueden tener distinto potencial patógenico y distintas características antigénicas (serotipo).
Por lo tanto, la caracterización de las cepas de H. parasuis es esencial para el diagnóstico preciso de la enfermedad y su control. Además, la situación en las granjas puede complicarse por la presencia de otros patógenos en los animales. Se ha observado que la infección por algunos virus, como el virus del PRRS, PCV2 o el virus de la gripe, está asociada con una mayor probabilidad de sufrir enfermedades bacterianas, como la enfermedad de Glässer.
Estas infecciones víricas provocan una alteración del sistema inmune que favorece que cepas con bajo potencial patogénico sean aisladas de lesiones, que por ellas mismas no podrían causar
Diagnóstico clínico y patológico
El diagnóstico de la enfermedad de Glässer, como otras enfermedades infecciosas, debe incluir el diagnóstico clínico y patológico junto con la confirmación del agente etiológico en el laboratorio.
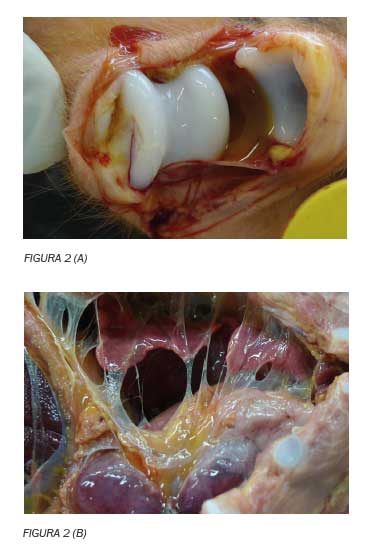
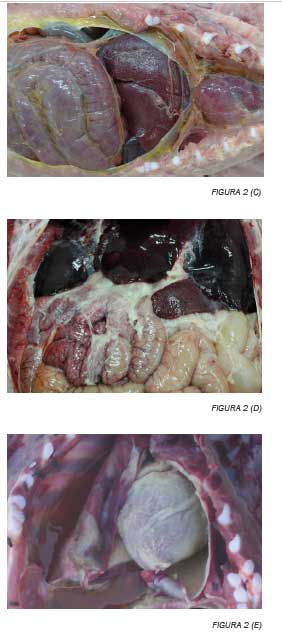
La enfermedad de Glässer se manifiesta con un cuadro clínico inespecífico de fiebre alta, tos, respiración abdominal, articulaciones inflamadas y cojera, y signos de afectación del sistema nervioso central, como decúbito lateral, pedaleo o temblores. En la necropsia, los animales con enfermedad aguda presentan las lesiones típicas de poliserositis fibrinosa (Figura 2).
Estas lesiones pueden incluir pleuritis, pericarditis, peritonitis, artritis y meningitis. En algunos casos puede observarse neumonía catarral purulenta. Algunos animales con signos clínicos leves o moderados pueden sobrevivir a la enfermedad, pero pueden quedar afectados de forma crónica. En estos animales se observa reducción en el crecimiento y en la necropsia pueden verse lesiones de poliserositis fibrosa.
Diagnóstico en el laboratorio

Muestras para diagnóstico
Las muestras deben tomarse de lesiones sistémicas, evitando contaminaciones del medio ambiente o de la piel del lechón, ya que H. parasuis es una bacteria de crecimiento lento y las contaminaciones podrían enmascarar su presencia.
Los fluidos de las cavidades afectadas son también una muestra adecuada para diagnóstico. Para garantizar la supervivencia de la bacteria, las muestras deben transportarse en refrigeración y en el caso de hisopos, en medio de transporte Amies. Las muestras del tracto respiratorio son más problemáticas, ya que los lechones son colonizados poco después del nacimiento y se pueden encontrar varias cepas en su cavidad nasal.
Estas cepas incluyen cepas no virulentas, que son miembros de la microbiota respiratoria normal de los lechones. Así, las muestras del tracto respiratorio superior no tienen valor diagnóstico, y las muestras de pulmón sólo deben tomarse en caso de neumonía. Mientras que, como se ha dicho, existen varias cepas en una misma granja, normalmente es una única cepa la responsable del cuadro clínico.
Si se aíslan varias cepas diferentes de las lesiones de los lechones, debemos cuestionarnos si no existe un proceso primario debido a otro patógeno que esté facilitando la invasión de cepas diversas de H. parasuis desde el tracto respiratorio superior.
Técnicas de diagnóstico
El diagnóstico en el laboratorio incluye técnicas clásicas de aislamiento bacteriano junto con técnicas de PCR tanto de identificación como caracterización. La aplicación de la PCR en la identificación acelera el diagnóstico, pero siempre es recomendable realizar el aislamiento bacteriano, ya que permite realizar técnicas de caracterización bacteriana complementarias.
Como se ha dicho anteriormente, H. parasuis incluye cepas no virulentas, y cepas virulentas capaces de producir enfermedad. La caracterización de la capacidad patogénica de una cepa puede ser un proceso complejo, que implicaría realizar pruebas de virulencia tanto in vitro como in vivo.
Es evidente que esto no se puede realizar en un diagnóstico rutinario, pero ha sido la base de investigaciones que han llevado al diseño de pruebas moleculares. Cabe destacar la aplicación de la PCR para determinar el serotipo y la capacidad patogénica de las cepas de H. parasuis.
PCR asociada a virulencia
La patogenia de la enfermedad de Glässer es un proceso complejo y ha sido objeto de múltiples investigaciones. La identificación de factores de virulencia y genes asociados a cepas de origen clínico ha permitido diseñar varias PCRs con el fin de determinar el potencial patogénico de los aislados.
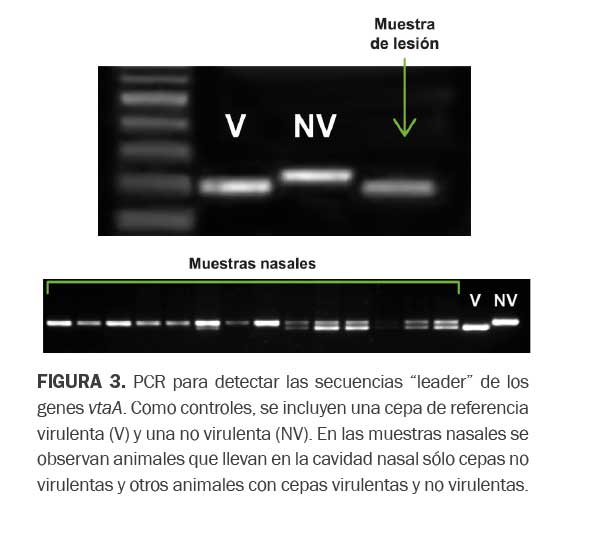

Estas PCR dirigidas a detectar cepas virulentas pueden ser aplicadas en muestras nasales y así detectar la presencia de cepas virulentas de H. parasuis en la granja y evaluar el riesgo a desarrollar la enfermedad de Glässer (Figura 3).
Control de la enfermedad de Glässer
Tratamientos antibióticos
El diagnóstico específico y completo es esencial a la hora de implementar medidas de control. Los antibióticos administrados rápidamente siguen siendo útiles para el tratamiento de la enfermedad de Glässer, pero se han descrito muchas resistencias y multiresistencias en H. parasuis.
La elección del antibiótico debe confirmarse con la susceptibilidad al mismo de la cepa que está ocasionando el brote clínico. La vía parenteral sería la más recomendable, ya que los lechones afectados pueden tener una ingestión menor de pienso y agua.
Por otro lado, el tratamiento colectivo de todo un lote y la prevención de los brotes clínicos mediante tratamientos metafilácticos perinatales está llamada a desaparecer por la presión para reducir el uso de antibióticos y por su posible efecto deletéreo sobre la microbiota. Hay que tener en cuenta que estos tratamientos se usan cuando los lechones comienzan a colonizarse y a desarrollar su sistema inmune.
Papel de los anticuerpos en protección
El papel de los anticuerpos en la protección frente a la enfermedad de Glässer está bien establecido, y se ha podido demostrar en experimentos de transferencia pasiva de anticuerpos.
En el laboratorio se ha demostrado que un papel relevante de los anticuerpos es la opsonización de las cepas para su detección y posterior captación por los macrófagos alveolares para su destrucción. Así, las cepas virulentas, que son resistentes a la fagocitosis, tras su opsonización de vuelven sensibles a la misma (Olvera et al., 2009).
Vacunación y Serotipos de Haemophilus parasuis
La vacunación es una herramienta que puede garantizar un nivel adecuado de anticuerpos en los animales. Las bacterinas (cepas inactivadas) son capaces de inducir anticuerpos, aunque estos no proporcionan una protección universal frente a todas las cepas virulentas, sino que depende del serotipo de la cepa. Algunos estudios han observado protección cruzada con algunas cepas de distinto serotipo, pero también se ha visto falta de protección entre cepas del mismo serotipo.
Así, a la hora de implementar una vacuna es importante caracterizar el serotipo de la cepa que causa la enfermedad. Se han defi nido 15 serotipos en H. parasuis, basados en antígenos solubles de las cepas. Los serotipos 1, 2, 4, 5, 10, 12, 13, 14 y 15 se han asociado con cepas virulentas, mientras que los serotipos 3, 6, 7, 8, 9 y 11 se han asociado a cepas no virulentas.
Sin embargo, esta asociación entre serotipo y virulencia no es estricta y existen cepas dentro del mismo serotipo con distinta capacidad patogénica. Es posible que esta falta de asociación venga dada no sólo porque la virulencia del serotipo se definió con una única cepa de referencia, sino por problemas de repetitividad y estandarización de los resultados de la serotipación clásica.
Estos últimos problemas se han solventado con el desarrollo de un conjunto de PCRs que detectan genes específicos de cada serotipo (Howell et al., 2015). Estas PCRs permiten la serotipación molecular de las cepas, lo que supone un avance evidente por la mejora en la accesibilidad a la técnica (muy pocos laboratorios eran capaces de realizar la serotipación clásica) y por la fácil estandarización de este tipo de técnicas.
Las autovacunas pueden considerarse como alternativa cuando las vacunas comerciales no presentan reacción cruzada con la cepa de la granja. Sin embargo, hay que ser conscientes de que estos productos no pasan por los estrictos controles de seguridad y eficacia de las vacunas comerciales.
Finalmente, diversos estudios han identificado factores de virulencia, presentes únicamente en las cepas virulentas, que podrían usarse como vacunas dirigidas en exclusiva frente a las cepas capaces de producir enfermedad.
Inmunidad y enfermedad
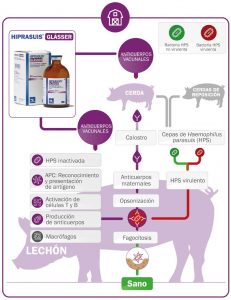
La colonización por H. parasuis se produce por contacto con la cerda juntamente con la transferencia de los correspondientes anticuerpos a través del calostro (Figura 4). La toma de calostro es esencial en la salud de los lechones, que nacen sin protección inmunológica propia.
La enfermedad de Glässer es más habitual en la fase de transición, cuando, tras el destete, se produce una reducción de los anticuerpos maternales. Esta reducción de anticuerpos maternales se observa normalmente a las 4-5 semanas de vida.
Para garantizar un nivel adecuado de anticuerpos en los lechones, se puede intervenir vacunando a cerdas o lechones. Los test de ELISA no son muy usados en el diagnóstico de la enfermedad de Glässer, pero pueden usarse para medir el nivel de anticuerpos en los animales.
Cuándo y a quién vacunar
El análisis del nivel de anticuerpos en la granja puede ser muy útil para establecer un programa óptimo de vacunación, evitando la interferencia de la inmunidad maternal y asegurando un buen nivel de anticuerpos en el momento de mayor riesgo de desarrollo de la enfermedad.
La vacunación simultánea de cerdas y lechones es también una opción, pero los resultados en la literatura son más conflictivos, ya que en algunos casos se observó interferencia de la inmunidad maternal (Pomorska-Mól et al., 2011) y en otros no se observó esta interferencia (Solano-Aguilar et al., 1999). En el último caso también se observó que la protección obtenida con la doble vacunación era equivalente a la de vacunar sólo cerdas (Solano-Aguilar et al., 1999; Baumann & Bilkei 2002).
En los cuadros de enfermedad muy tempranos, entre 4-6 semanas de vida, la opción preferente es posiblemente la vacunación de las madres, ya que la vacunación excesivamente temprana en los lechones podría verse afectada por la interferencia de la inmunidad maternal.
Además, el tiempo antes del brote es insuficiente para que la vacunación de lechones sea totalmente efectiva. La vacunación de cerdas favorece la transferencia a través del calostro de un nivel mayor de anticuerpos, que son detectables hasta las 6-8 semanas de vida de los lechones. Además tiene el efecto de reducir la colonización de los lechones por H. parasuis (Cerdà-Cuéllar et al., 2010), lo que podría favorecer un mayor control de la enfermedad.
Si la enfermedad aparece más tardíamente, a partir de las 8 semanas de vida, la opción de vacunar a los lechones sería más adecuada para garantizar que en el momento del brote tengan un nivel suficiente de anticuerpos. Un caso especial en que también se debería considerar la vacunación es antes de introducir animales de reposición desde núcleos de muy alta sanidad. Esta reposición debería vacunarse en origen.
Tras un diagnóstico detallado para determinar la causa primaria de los cuadros clínicos, las vacunas frente a enfermedades bacterianas tienen que ganar el terreno ocupado por los antibióticos para el control de estas enfermedades.




